При межмолекулярном взаимодействии происходит взаимное влияние друг на друга соседних молекул или атомов. Эти частицы изначально должны быть нейтральными, т.е. электрически незаряженными.
Изучая свойства газообразных веществ и жидкостей, он пришел к выводу, что есть особые силы, благодаря которым между молекулами возникает притяжение. Их существование через некоторое время было подтверждено, и они стали называться Ван-дер-Ваальсовыми силами (это одна из разновидностей межмолекулярного взаимодействия).Предположение о существование такого взаимодействия впервые высказал в 1873 году голландский ученый Я.Д. Ван-дер-Ваальс.
Силы, возникающие при межмолекулярном взаимодействии, подразделяются на две категории:
- силы притяжения;
- силы отталкивания.
Силы притяжения
Эти силы являются самыми значимыми для взаимодействия между частицами вещества. По своей природе они являются электростатическими. Силы притяжения, в свою очередь, подразделяются еще на две разновидности:
- Ван-дер-Ваальсовы силы: их действие распространяется сразу на всю молекулу;
- водородные связи: сфера их влияния ограничена отдельными участками.
Ван-дер-Ваальсовы силы
Эти силы по отношению к объему распространения их влияния являются близкодействующими. Их зона влияния распространяется на расстояние, не превышающее 0,3-0,5 нм.
Именно воздействием Ван-дер-Ваальсовых сил можно объяснить такие явления, как:
- сцепление в космическом пространстве между собой частиц, которые можно считать мелкими астероидами;
- кольца планет-гигантов, особенно планеты Сатурн (кольца Сатурна доступны для наблюдения с Земли даже в самый слабый телескоп);
- способность гекконов передвигаться по совершенно гладким поверхностям, таким как стекло.
Существует три их разновидности:
- дипольные (ориентационные) силы;
- индукционные (деформационные) силы;
- дисперсионные силы.
Дипольные силы можно наблюдать в полярных молекулах в процессе взаимодействия их диполей. Вокруг дипольной молекулы образуется электростатическое поле и происходит ориентация других диполей системы. Наибольшая сила притяжения между полярными молекулами отмечается в ситуации, когда их дипольные моменты расположены вдоль одной прямой. Возникновение такой силы обусловлено тем, что разноименные заряды отделены друг от друга несколько меньшим расстоянием, чем одноименные.
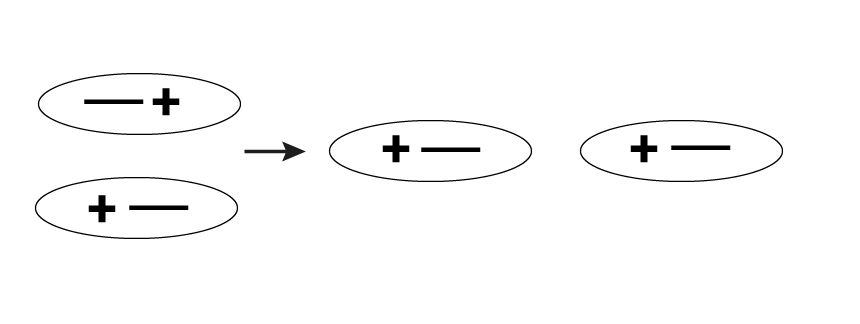
Значение энергии, высвобождающейся при подобном взаимодействии, находится в прямой зависимости от величины дипольных моментов и относительного положения диполей. Силой, противодействующей молекулярной ориентации, в данном случае является тепловое движение. Это значит, что энергия взаимодействия зависит в том числе и от температуры:
где и – дипольные моменты молекул, которые участвуют во взаимодействии,
– постоянная Больцмана (ее значение 1,38066·1023 Дж/К),
– температура,
– расстояние, которым разделены молекулы.
Индукционные силы возникают между двумя молекулами, одна из которых является полярной, а другая – неполярной. Вокруг полярной молекулы образуется электрическое поле. Оно способствует поляризации молекулы с электрическими зарядами. Положительные заряды движутся в сторону электрического поля, а отрицательные – в противоположном от него направлении.
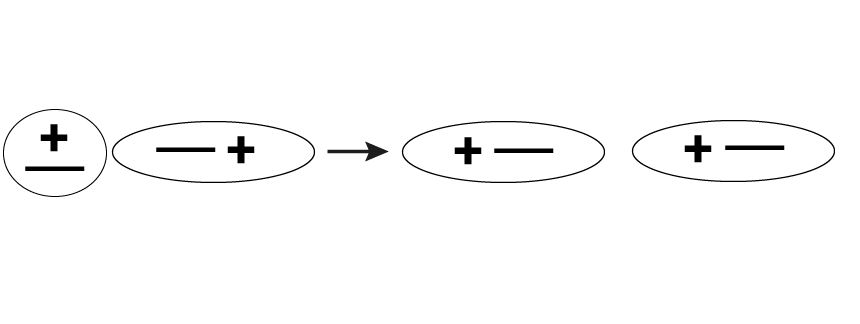
Количество энергии при индукционном взаимодействии увеличивается вместе с возрастанием дипольного момента и стремительно сокращается при увеличении расстояний между частицами. С температурой индукционные силы никак не связаны.
инд
где – значение степени поляризуемости неполярной молекулы.
Действие индукционных сил может наблюдаться также и между молекулами, обе из которых являются полярными.
Дисперсионные силы появляются вследствие движения электронов вокруг атомных ядер. Для правильного понимания их сущности атом можно представить в виде диполя, отрицательным полюсом которого является электрон, а положительным – протон. При этом наблюдается очень быстрое движение отрицательного полюса, т.е. электрона. В молекулах, расстояние между которыми небольшое, электроны движутся согласованно, и диполи оказываются расположенными по отношению друг к другу полюсами с противоположными значениями зарядов. Это приводит к тому, что они начинают притягиваться.
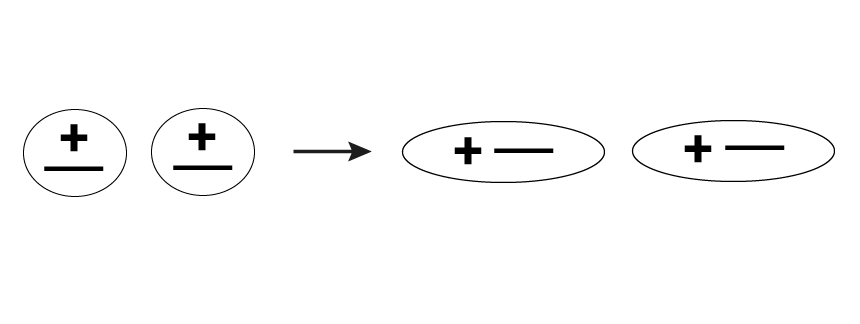
Природа дисперсионного взаимодействия была полностью раскрыта только после создания теории квантовой механики. С точки зрения этой теории получается, что в среднем по времени дипольные моменты у молекул, являющихся неполярными, имеют нулевое значение. Однако следует учитывать, что в любой момент времени каждый электрон занимает свое определенное положение. Из этого следует, что мгновенное значение дипольного момента не может быть равно нулю. Мгновенный диполь генерирует вокруг себя электрическое поле, вызывающее поляризацию расположенных по соседству молекул. Данные процессы приводят к взаимодействию мгновенных диполей.
Значение величины дисперсионного взаимодействия возрастает при ослаблении связи между электронами и ядром. Температура на ее значение влияния не оказывает.
дисп
где и – показатели поляризуемости молекул, находящихся в состоянии взаимодействия.
Данный вид взаимодействия получил название дисперсионного по той причине, что дисперсия света в веществе обусловлена такими же характеристиками молекул, как и в случае рассматриваемого процесса.
Возникновение дисперсионных сил не связано с наличием или отсутствием постоянных дипольных моментов, они возникают между всеми атомами или молекулами. Из всех трех разновидностей Ван-дер-Ваальсовых сил они считаются самыми мощными, их величина в большинстве случаев превосходит величину дипольных и индукционных сил. Например, в процессе взаимодействия молекул таких соединений, как CO или HBr, дисперсионные силы больше всех прочих в несколько десятков или даже сотен раз.
Исключение составляют лишь молекулы веществ с большими значениями дипольных моментов. Так, у молекул воды дипольные силы превосходят дисперсионные примерно в 3 раза.
Водородная связь
Особой формой межмолекулярных взаимодействий считается так называемая водородная связь. Как следует из названия, она возникает между молекулами, в составе которых содержатся атомы водорода. Она может формироваться в ситуации, при которой атом водорода соединен ковалентной связью с другим атомом, обладающим значительной электроотрицательностью, вследствие чего формируется частичный положительный заряд на атоме водорода. Такая связь образуется между двумя молекулами, при этом одна из молекул должна содержать частично положительно заряженный атом водорода, а другая – атом элемента с частичным отрицательным зарядом, который содержит неподеленную пару электронов.
Рассмотрим характерные особенности водородной связи на примере молекулы воды. В ней связи O-H характеризуются сильной степенью полярности. Атом водорода обладает частичным положительным зарядом, а атом кислорода – частичным отрицательным. Отметим также, что у атома кислорода имеются 2 неподеленные электронные пары. В результате молекула H2O образует 4 водородные связи с находящимися рядом молекулами этого же вещества. Каждая молекула в 2 водородных связях является донором пары атомов водорода с частичным положительным зарядом, а в оставшихся 2 – донором 2 неподеленных пар электронов атома кислорода. В результате образуется сетчатая структура, которая может быть представлена в 3 измерениях.
Именно наличием водородной связи обусловлена межмолекулярная ассоциация таких соединений, как фторид водорода, аммиак, спирты, карбоновые кислоты.
Если учитывать степень электроотрицательности элементов, не составит труда понять, что формирование самых сильных водородных связей будет происходить с участием атомов фтора. Для атомов кислорода их сила меньше, далее, у атомов азота она становится еще меньше. Возникновение водородных связей возможно также и внутри молекулы, если в ней содержатся протонодонорные и протоноакцепторные группы.
По прочности водородные силы превосходят Ван-дер-Ваальсовы. Однако энергия их все же не настолько велика, чтобы связь между частицами оставалась стабильной. Без особых изменений параметров среды межмолекулярная связь может не только легко разрушаться, но и без труда восстанавливаться. Это играет огромную роль для жизни всех известных живых организмов. Большинство протекающих в них биохимических процессов основано на формировании или разрушении водородной связи.
Силы отталкивания
Силы отталкивания начинают действовать, когда межмолекулярное расстояние сокращается до предельно возможного минимума. При таком сближении начинают соприкасаться внешние уровни электронов двух атомов. Как следует из принципа Паули, являющегося одним из базовых положений квантовой механики, заполненные электронные оболочки не могут проникать одна внутрь другой. Величина таких сил в значительной степени зависит от особенностей строения молекулы определенного вещества.
Возникли трудности с работой по этой теме? У нас вы можете заказать научную статью по химии по низкой цене!



Комментарии