Средняя соль серной кислоты H2SO4 и гидроксида бериллия Be(OH)2.
Химическая формула
BeSO4
Получение
Лабораторные методы получения
Сульфат бериллия получают взаимодействием серной кислоты с гидроксидом или карбонатом бериллия:
H2SO4 + Be(OH)2 = BeSO4 + 2H2O;
H2SO4 + BeCO3 = BeSO4 + H2O + CO2.
Получение сульфата бериллия в промышленности
В промышленности сульфат бериллия получают из карбоната бериллия и серной кислоты:
H2SO4 + BeCO3 = BeSO4 + H2O + CO2.
Свойства сульфат бериллия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Белое твердое кристаллическое вещество |
| Молярная масса | 105,075 г/моль (безв.), |
| Плотность | 2,50 г/см3 (безв.), 1,71 г/см3 (кристаллогидрат) |
| Показатель преломления | 1,4374 |
| Температура разложения | 550°С |
| Растворимость в воде, | |
| г/100 г | при 25°С — 42,4 при 100°С — 100 |
Химические свойства
При растворении в воде сульфат бериллия диссоциирует на ионы:
BeSO4 ↔ Be+ + SO42-.
Раствор имеет кислую реакцию из-за гидролиза.
Гидролиз протекает по катиону (две ступени). Наличие катионов H+свидетельствует о кислом характере среды.
Первая ступень:
BeSO4 ↔ Be2+ + SO42-;
Be2+ + HOH ↔ BeOH+ + H+;
Be2+ + SO42- + HOH ↔ BeOH+ + SO42- + H+;
2BeSO4 + 2H2O ↔ [Be(OH)]2SO4 + H2SO4.
Вторая ступень:
[Be(OH)]2SO4 ↔ 2BeOH+ + SO42-;
BeOH+ + HOH ↔ Be(OH)2↓ + H+;
BeOH+ + SO42- + HOH ↔ Be(OH)2↓ + SO42- + H+;
[Be(OH)]2SO4 + 2H2O ↔ 2Be(OH)2↓ + H2SO4.
Вступает в реакции обмена с образованием нерастворимых сульфатов:
BeSO4 + CaCl2 = 2NaCl + CaSO4↓,
BeSO4 + SrCl2 = 2NaCl + SrSO4↓,
BeSO4 + BaCl2 = 2NaCl + BaSO4↓.
Вступает в реакции обмена с образованием нерастворимых солей бериллия:
BeSO4 + Na2CO3 = Na2SO4 + BeCO3↓,
3BeSO4 + 2Na3PO4 = 3Na2SO4 + Be3(PO4)2↓,
BeSO4 + BaCl2 = 2NaCl + BaSO4↓.
При добавлении щелочи получается осадок основной соли:
2BeSO4 + 2KOH = (BeOH)2SO4↓ + K2SO4.
Состав осадка непостоянен, поскольку бериллий склонен к комплексообразованию и полимеризации.
При дальнейшем добавлении щелочи сульфат-ионы замещаются ионами гидроксила:
(BeOH)2SO4↓ + 2KOH = 2Be(OH)2↓ + K2SO4.
Гидроксид бериллия амфотерен и растворяется в избытке щелочи:
2KOH + Be(OH)2 = K2[Be(OH)4].
При нагревании до температуры 547 – 600oС сульфат бериллия разлагается:
BeSO4 = BeO + SO3.
Из растворов сульфат бериллия осаждается в виде кристаллогидрата BeSO4·4H2O.
При нагревании до 115oС от него отщепляются 2 молекулы воды:
BeSO4·4H2O = BeSO4·2H2O + 2H2O,
При 250oС отщепляются еще одна молекул воды:
BeSO4·2H2O = BeSO4·H2O + H2O.
При 400oС получается безводный сульфат бериллия:
BeSO4·H2O = BeSO4 + H2O.
Применение
Применение сульфата бериллия весьма ограничено. Известно, что некоторое время его в смеси с сульфатом радия использовали в качестве источника нейтронов в атомных реакторах.
Кроме этого в фармакологии сульфат бериллия применяют как одну из составляющих некоторых гомеопатических препаратов.
Относится к очень ядовитым веществам (1 класс опасности).
Пример решения задачи
Задача 1
Назовите 4 способа получения сульфата бериллия.
Решение
H2SO4 + Be(OH)2 = BeSO4 + 2H2O;
H2SO4 + BeCO3 =BeSO4 + H2O + CO2;
H2SO4 + BeO =BeSO4 + H2O;
SO3 + BeO = BeSO4.
Задача 2
Сколько мл 5% едкого натра надо добавить к 50 мл 10% раствора сульфата бериллия для полного растворения первоначально выпавшего осадка?
Решение
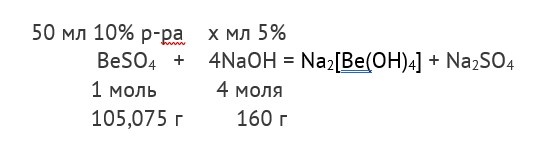
В 50 мл 10% раствора сульфата бериллия содержится 50*10/100=5 г BeSO4, считая плотность раствора равной 1г/см3.
Получим пропорцию:
105,075 г BeSO4 – 160 г NaOH,
5 г BeSO4 – х г NaOH.
Отсюда
х= 5*160105,075 = 7,61 г.
В 100 мл 5% р-ра NaOH содержится 5 г NaOH, в х мл 5% р-ра NaOH содержится 7,61 г NaOH.
х= 7,61*1005 = 152 мл.
Ответ: 152 мл.
Не получается самостоятельно разобраться с темой? Заказать написание статьи по химии!



Комментарии