Соль, образованная слабым основанием (NH4OH) и сильной кислотой (HCl).
Альтернативное название
Аммоний хлористый, нашатырь
Формула
NH4Cl
Свойства хлорида аммония
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные кристаллы, слегка расплывающиеся на воздухе |
| Молярная масса | 53,5 г/моль |
| Плотность | при 25°С – 1,073 г/см3 |
| Показатель преломления (для D-линии натрия) | 1,642 (20°C) |
| Температура возгонки | 337,6°С (с разл.) |
| Растворимость в воде, г/100 г | при 0°С – 29,4 при 20°С – 37,2 при 50°С – 50,4 при 100°С – 74,3 |
Химические свойства
В водном растворе диссоциирует на ионы:
NH4Cl ↔ Cl- + NH4+.
Уравнение гидролиза:
NH4Cl + Н2О = H+ + Cl- + NH4OH.
Среда раствора кислая.
При реакции с концентрированной серной кислотой образуется хлороводород:
2NH4Cl + H2SO4 = 2HCl + (NH4)2SO4.
При реакции со щелочами или оксидами и гидроксидами щелочноземельных металлов образуется аммиак:
NH4Cl + NaOH = NaCl + NH3↑ + Н2О,
2NH4Cl + CaO = CaCl2 + 2NH3↑ + Н2О.
При нагревании выше 337,6°С разлагается на аммиак и хлороводород:
NH4Cl = NH3↑+ HCl↑.
Получающиеся газы вновь превращаются в хлорид аммония, возникающего в виде белого дыма («дым без огня»).
Получение
Получение в естественных условиях
В Древнем Египте и Древней Греции нашатырь соскребали на стенах вулканических пещер. Египтяне его использовали для курений богу Аммону, отсюда произошло название «аммоний». А вот само слово «нашатырь» арабского происхождения (от арабского названия «нушадир»).
Получение в лаборатории
Хлорид аммония получают из гидроксида аммония (нашатырного спирта) и соляной кислоты:
NH4OH + HCl = NH4Cl + Н2О.
Получение в промышленности
Хлорид аммония получают как побочный продукт при производстве пищевой соды (гидрокарбоната натрия):
NaCl + NH3 + CO2 + Н2О = NaHCO3 + NH4Cl.
Применение
- Хлорид аммония применяют при изготовлении сухих батарей, гальванических элементов.
- В химии его используют для удаления оксидной пленки при пайке и лужении стали.
- В сельском хозяйстве как удобрение (в ограниченном количестве).
- В медицине его применяют как диуретическое средство при отеках сердечного происхождения.
- В текстильной индустрии — для отверждения клеев и лаков.
- При изготовлении фитилей для свечей.
- При изготовлении сигнальных дымовых шашек, как дымообразователь.
- В деревообрабатывающей промышленности используют для борьбы с вредителями.
Примеры решения задач
Задача 1
Сколько хлорида аммония получается при производстве 1 т пищевой соды по аммиачному методу?
Решение
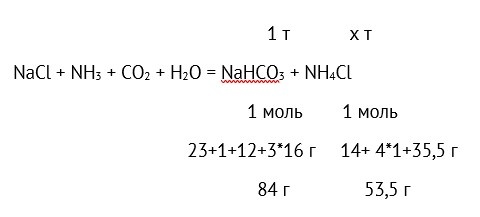
Составляем пропорцию:
84 г NaHCO3 – 53,5 г NH4Cl,
1 т NaHCO3 – х т NH4Cl
отсюда
х=1 * 53,5 / 84 = 0,637 т = 637 кг.
Ответ: 637 кг.
Задача 2
Сколько тепла выделится при сгорания 34 г аммиака в атмосфере хлора?
Решение
34 г
8NH3 + 3Cl2 = N2 + 6NH4Cl
8 моль
8 (1+16) г
136 г
Изменение энтальпии в ходе химической реакции:
.
Составляем пропорцию:
136 г NH3 – 1515,68 кДж,
34 г NH3 – х кДж.
отсюда
х=34 * 1515,68 / 136 = 378,92 кДж.
Ответ: 378,92 кДж.
На Студворк вы можете заказать статью по химии онлайн у профильных экспертов!



Комментарии